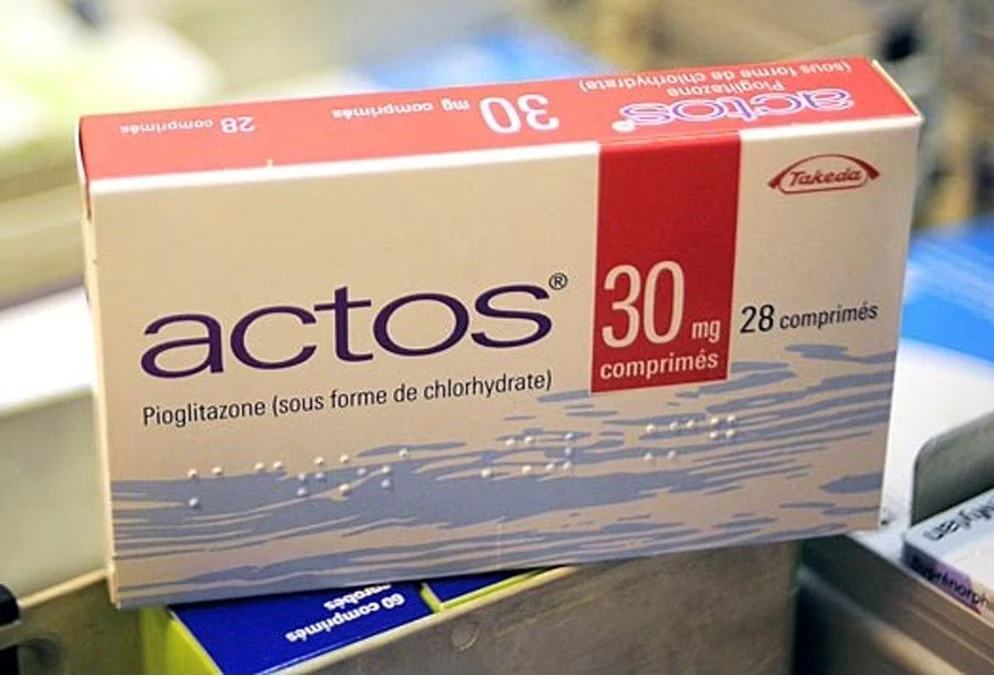
Farmaco diabete Actos principio attivo pioglitazone: ritirato in Francia e Germania per rischio cancerogenicità.
Il trattamento a base di Pioglitazone viene utilizzato per gestire il daibete di tipo 2. Il Pioglitazone agisce aumentando la sensibilità all’insulina, ormone che partecipa al controllo dei livelli di zuccheri nel sangue.
I farmaci che utilizzano il principio attivo pioglitazone sono commercializzati dall’azienda giapponese Takeda Pharmaceutical e dalla statunitense Eli Lilly, con il nome Actos, una specialità medicinale che da anni è stata sotto accusa per i gravissimi effetti collaterali provocati sui pazienti.
In Francia e Germania questo tipo di farmaci sono stati vietati, ma in Italia non sono ancora state prese precauzioni nonostante il diffuso allarme.
A darne tutti i dettagli e a diffondere la notizia è stato anche il dott. Domenico De Felice in un articolo pubblicato su Il Fatto Quotidiano.
Risultati studi su pioglitazone
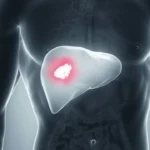
I dati dicono, che a seguito di uno studio durato 10 anni, ordinato dalla FDA americana, commissionato e finanziato dalla stessa Takeda, il farmaco Actos contro il diabete è risultato associato ad una elevata incidenza di tumore al pancreas.
“In tale studio, che ha coinvolto esclusivamente pazienti diabetici, oltre 200mila, dividendoli fra utilizzatori e non utilizzatori del farmaco, è emerso che fra gli utilizzatori il letale tumore al pancreas si è manifestato con frequenza decisamente maggiore (soprattutto entro il primo anno di assunzione) di 81 casi annuali ogni 100.000 pazienti contro una normale incidenza che è di poco più di 12 casi annuali ogni 100.000 persone.”
Nonostante questi gravi effetti collaterali siano ormai noti da anni (si parla del 2015), Actos è ancora in vendita in Italia.
Inoltre, già nel 2007, l’Agenzia del Farmaco Italiana in una nota sul Bollettino di Informazione sui Farmaci (BIF) avvertiva “sui rischi associati all’assunzione di rosiglitazone e pioglitazone”, farmaci che aumentano la sensibilità dei tessuti all’azione dell’insulina:
“Negli anni successivi alla loro commercializzazione”,[…] sono state segnalate nuove reazioni avverse associate all’assunzione di questi farmaci, quali edema maculare con diminuzione della vista, fratture distali e infarto del miocardio per quanto concerne il rosiglitazone, e cancro alla vescica per il pioglitazone. Queste segnalazioni hanno stimolato l’attenzione della comunità scientifica e hanno portato le agenzie regolatorie a rivalutare il rapporto rischio-beneficio di questi farmaci”.
Per tali elevati rischi sulla salute dei pazienti, Francia e Germania hanno sospeso la commercializzazione di Actos già dal 2011. La decisione fu presa in seguito a uno studio ufficiale dell’istituzione sanitaria francese, condotto tra il 2006 e il 2009, in cui è emerso un rischio leggermente più alto di contrarre il cancro alla vescica, per coloro che assumevano il farmaco.
(Fonti consultate: ambientebio.it, Il Fatto Quotidiano)